|
| A ebulioscopia engloba o conceito de ebulição. |
- I - Introdução
- II - Pressão máxima de vapor e tonoscopia
- III - Ebulioscopia
- IV - Crioscopia
- V - Osmoscopia
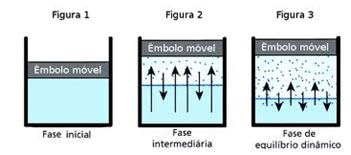
Ebulição
Quando a temperatura alcança o ponto cuja pressão de vapor é igual à pressão atmosférica, ocorre vaporização em todo o líquido, e não mais somente na superfície. Nessa temperatura, o vapor formado pode afastar a atmosfera e criar espaço para si. Assim, bolhas de vapor formam-se no líquido e sobem rapidamente até a superfície.
De acordo com o diagrama de fases, em pressões menores o líquido ferve a temperaturas menores e vice-versa. Isso explica porque líquidos aquecidos em lugares com altitude elevada fervem com mais facilidade, isto é, a uma temperatura menor.
Quando a pressão de vapor do líquido se iguala à pressão atmosférica, o líquido entra em ebulição.
Uma definição correta de ponto de ebulição de um líquido é a temperatura em que a pressão de vapor do líquido se iguala à pressão atmosférica.
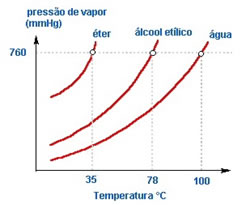
Veja por exemplo alguns pontos de ebulição, tomando como referência a pressão atmosférica como 1 atm ou 760 mmHg:
Veja que o éter e o álcool etílico entram em ebulição com maior facilidade que a água, já que são mais voláteis, ou seja, suas forças moleculares são mais fracas.
O ponto de ebulição de uma substância é diretamente proporcional às suas forças
intermoleculares e sua massa molar.
Ebulioscopia
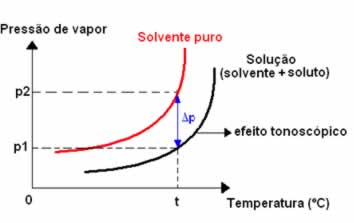
A ebulioscopia é uma propriedade coligativa que determina que:
O ponto de ebulição de uma solução cujo soluto não é volátil é maior do que o ponto de
ebulição do solvente puro, sob mesma pressão.
Representando graficamente: (o valor de referência da pressão é a pressão atmosférica local)
Podemos relacionar o estudo prático da ebulioscopia com a Lei de Raoult, vista anteriormente, dessa forma:
Δe = kₑ × W ou t - t₂ = kₑ × W
t = ponto de ebulição do solvente em solução
t₂ = ponto de ebulição do solvente puro
kₑ = constante ebuliométrica
Ou seja, a diferença entre os pontos de ebulição do solvente em solução e do soluto ou efeito tonoscópico é o produto entre a constante ebuliométrica e a concentração molal dessa solução. Perceba que quanto maior a concentração molal, maior a variação no ponto de ebulição.
A constante ebuliométrica é dada por:
R = constante dos gases ideais = 2 cal × K⁻¹ × mol⁻¹
T = temperatura absoluta de ebulição do solvente puro, em Kelvin (K)
Lv = calor latente de vaporização em cal × g⁻¹
Para soluções iônicas, devemos aplicar o fator de correção de van't Hoff:
Δe = kₑ × W × i ou t - t₂ = kₑ × W × i