 |
| Tonoscopia refere-se à pressão de vapor. |
- I - Introdução
- II - Pressão máxima de vapor e tonoscopia
- III - Ebulioscopia
- IV - Crioscopia
- V - Osmoscopia
Pressão máxima de vapor
Como a água das salinas evapora se a água só ferve a 100 ºC? As moléculas de qualquer líquido estão sempre em movimento. Algumas, com velocidades mais altas, conseguem escapar da superfície do líquido para a atmosfera.
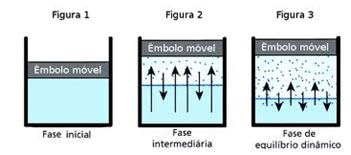
Considere então um líquido colocado em um recipiente fechado. As moléculas do líquido escaparão do líquido entrando na fase de vapor assim como as moléculas de vapor podem entrar em contato com o líquido voltando à fase líquida, já que as moléculas estão em constante movimento. Como o recipiente está fechado, haverá um momento em que a evaporação vai parar, ao menos aparentemente.
Na realidade, continua havendo evaporação e condensação. No entanto, se uma molécula de líquido evaporar, outra molécula de vapor terá que condensar. Daí dizemos que o vapor e o líquido estão em equilíbrio dinâmico:
Nesse estágio, os vapores estão saturados, e uma pressão máxima foi alcançada. A essa pressão damos o nome de pressão máxima de vapor:
Pressão máxima de vapor de um líquido é a pressão exercida
por seus vapores quando estes estão em equilíbrio dinâmico com o líquido.
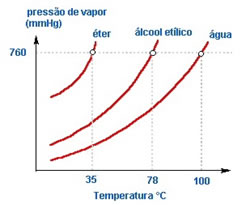
Dizemos que um líquido é volátil quando sua pressão de vapor é alta em temperaturas ambientes, e volatilidade refere-se a capacidade de uma substância passar do estado líquido para o estado de vapor.
Logicamente, temperaturas maiores significam maior agitação das moléculas, e portanto maior volatilidade.
Quanto às forças intermoleculares, líquidos formados por moléculas com forças mais fortes como ligações de hidrogênio mantêm as moléculas mais unidas, diminuindo sua volatilidade. Por exemplo, o éter dietílico possui forças de Wan der Walls, que são menos intensas que as forças da água, ligações de hidrogênio. Por isso, a uma mesma temperatura, o éter dietílico possui maior pressão máxima de vapor que a água.
Perceba também que a pressão de vapor não depende da quantidade de líquido.
Tonoscopia
Tonoscopia é uma propriedade coligativa que ocasiona o seguinte:
A adição de um soluto não-volátil em um solvente provoca a diminuição da sua
pressão máxima de vapor.
pressão máxima de vapor.
Isso se explica pelo fato de que as moléculas de soluto retardam o movimento das moléculas, diminuindo a velocidade de evaporação. Sendo uma propriedade coligativa, podemos afirmar:
Quanto maior o número de partículas dispersas, menor a pressão de vapor.
Água pura (25 ºC): P.V. = 23,76 mmHg
Solução 1 mol/L de glicose (25 ºC): P.V. = 23,34 mmHg
Solução 1 mol/L de sacarose (25 ºC): P.V. = 23,34 mmHg
Veja que as pressões de vapor da glicose e da sacarose são iguais, mostrando que essa propriedade depende somente do número de partículas em solução.
Em resumo:
Em resumo:
A pressão de vapor de um solvente é proporcional à temperatura
e inversamente proporcional às suas forças intermoleculares e
à concentração de soluto presente na solução.
Lei de Raoult
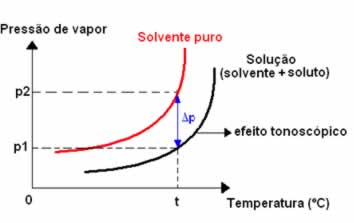
O abaixamento da pressão de vapor ou efeito tonoscópico é expresso por Δp = p₂ - p, sendo p₂ a pressão máxima de vapor do solvente puro e p a pressão máxima de vapor do solvente em solução.
Experimentalmente, o físico-químico francês François Marie Raoult (1830 - 1901) determinou a seguinte expressão:
Numa solução ideal, o abaixamento da pressão máxima de vapor (Δp) em relação á pressão
máxima de vapor do solvente puro (p₂) é igual à fração em quantidade de matéria do soluto (X₁).
Já o agrônomo alemão Von Babo (1790 - 1862) observou que a relação Δp/p₂ não varia com a temperatura, enquanto a pressão de vapor de solvente puro (p₂) e o abaixamento da pressão máxima de vapor (Δp) variam com a temperatura.
Podemos deduzir matematicamente e chegar a seguinte e importante expressão:
Podemos deduzir matematicamente e chegar a seguinte e importante expressão:
kₜ é chamado de constante tonométrica do solvente, e W é a molalidade do soluto em relação ao solvente. Perceba que em soluções aquosas o valor da constante tonométrica sempre será constante, já que refere-se à massa molar do solvente, e não a do soluto. Para soluções aquosas, kₜ = 0,018 (18 / 1000).
Para soluções iônicas, temos que:












Nenhum comentário:
Postar um comentário