Química orgânica é o segmento da disciplina responsável pelo estudo dos compostos do carbono. Estudar as características do carbono envolve conhecimento sobre tipos de ligação, classificação do elemento químico e das cadeias carbônicas.Se a Química Orgânica estuda os compostos com carbono, a Química Inorgânica estuda os demais compostos, em geral minérios.Os compostos orgânicos são, na sua maioria, formados por C,H,O e N.
Utilidade:Os compostos orgânicos existem em maior quantidade em relação aos inorgânicos.Até 2005 já eram conhecidos 18.000.000 compostos orgânicos e hoje é uma das áreas mais estudadas na indústria química, a indústria do petróleo. Foi possível fabricar plásticos, como o náilon, poliéster e etc.Como compostos naturais orgânicos podemos citar o petróleo, gás natural, carvão mineral, etc.

Plataforma Petrolífera



Corantes, medicamentos e garrafas de polietileno
POSTULADOS DE KULELÉ
O químico alemão Friedrich August Kulelé foi quem estudou as principais características do átomo de carbono. Explicou as propriedades em forma de teorias:
1º Teoria de Kulelé: O carbono é tetravalente
C- 4A 1s2,2s2,2p6
Como o átomo de carbono possui 4 elétrons na sua última camada, ele tem quatro valências livres e pode fazer quatro ligações covalentes, formando moléculas. Desta forma, o átomo fica estável.

2º Teoria de Kulelé: O carbono tem 4 valências livres
O átomo de carbono tem as quatro valências livres. A posição do heteroátomo não difere os compostos.
Exemplo: clorofórmio (CH3Cl)

3º Teoria de Kulelé: O carbono forma cadeias carbônicas
Os átomos de carbono agrupam-se entre si, formando estruturas de carbono, ou cadeias carbônicas.

Agora vamos mais afundo no estudo das cadeias carbônicas:
CADEIA CARBÔNICA
Átomos do elemento carbono estão presentes em todas as moléculas orgânicas.E átomos do elemento hidrogênio, na maioria das vezes.Qualquer átomo em uma molécula orgânica que não seja de carbono ou de hidrogênio é denominado heteroátomo.
Classificando uma cadeia carbônica:
1-Tipo de ligação:1 par eletrônico – ligação simples C – C
2 pares eletrônicos – ligação dupla C = C
3 pares eletrônicos – ligação tripla C ≡ C
2-A quantos carbonos ele está ligado:Carbono Primário: ligado a um ou nenhum outro carbonos
Classificando uma cadeia carbônica:
1-Tipo de ligação:1 par eletrônico – ligação simples C – C
2 pares eletrônicos – ligação dupla C = C
3 pares eletrônicos – ligação tripla C ≡ C
2-A quantos carbonos ele está ligado:Carbono Primário: ligado a um ou nenhum outro carbonos
Carbono Secundário: ligado a dois outros carbonos
Carbono Terciário: ligado a três outros carbonos
Carbono Quarternário: ligado a quarto outros carbonos
3-Quando é cadeia aberta,fechada ou mista e quando é homogênea ou heterogênea
As cadeias abertas são chamadas também de cadeias acíclicas ou alifáticas. Apresentam duas extremidades ou pontas de cadeia.
As cadeias fechadas são também chamadas de cadeias cíclicas.
Apresentam seus átomos ligados entre si formando um ciclo figura geométrica ou anel.

As cadeias carbônicas mistas são abertas e também fechadas.

homogênea ou heterogênea classificam-se de acordo com a presença de um heteroátomo ou não entre carbonos.
- homogênea – não possui heteroátomos entre carbonos.

- heterogênea – possui heteroátomo entre carbonos.

As cadeias carbônicas também podem ser classificadas de acordo com a presença de radicais (ramificações) na cadeia carbônica.
- normal – não possui radicais.
- normal – não possui radicais.

- ramificada – possui radicais.

As cadeias carbônicas podem ser classificadas de acordo com o tipo de ligação química.
saturada – quando há na cadeia carbônica apenas ligações simples.
saturada – quando há na cadeia carbônica apenas ligações simples.

insaturada – quando há nas cadeias carbônicas ligações duplas ou triplas.

Podem ser classificadas quanto à presença de uma anel aromático ou não.
- alicíclica ou não aromática – são cadeias fechadas que não possuem o anel bezênico.

- alicíclica ou não aromática – são cadeias fechadas que não possuem o anel bezênico.

- aromática – são cadeias fechadas que possuem o anel aromático, ou anel benzênico. Possuem ressonância entre seus elétrons. Estas cadeias, em geral tem seis átomos de carbono que alternam ligações duplas e ligações simples.
 ou
ou  ou
ou 
 ou
ou  ou
ou 
As cadeias aromáticas podem ser classificadas de acordo com o número de anéis aromáticos:
- mononuclear: quando possui apenas um núcleo (anel aromático)
- mononuclear: quando possui apenas um núcleo (anel aromático)


- polinuclear: quando possui vários anéis aromáticos.


Os aromáticos polinucleares podem ser classificados em:
- polinucleares isolados: quando os anéis não possuem átomo de carbono em comum.

- polinuclear condensado: quando os anéis possuem átomos de carbono em comum.

- polinucleares isolados: quando os anéis não possuem átomo de carbono em comum.

- polinuclear condensado: quando os anéis possuem átomos de carbono em comum.

RESUMO

Petróleo e os Hidrocarbonetos
Na química, um hidrocarboneto é um composto químico constituído por átomos de carbono e de hidrogênio unidos tetraedricamente por ligação covalente assim como todos os compostos orgânicos.
Os hidrocarbonetos naturais são compostos químicos constituídos apenas por átomos de carbono (C) e de hidrogênio (H), aos quais se podem juntar átomos de oxigênio (O), azoto ou nitrogênio (N) e enxofre (S), dando origem a diferentes compostos de outros grupos funcionais.
São conhecidos alguns milhares de hidrocarbonetos. As diferentes características físicas são uma consequência das diferentes composições moleculares.Contudo, todos os hidrocarbonetos apresentam uma propriedade comum: oxidam-se facilmente liberando calor.
Os hidrocarbonetos naturais formam-se a grandes pressões no interior da terra (abaixo de 150 km de profundidade) e são trazidos para zonas de menor pressão através de processos geológicos, onde podem formar acumulações comerciais (petróleo, gás natural, carvão etc). As moléculas de hidrocarbonetos, sobretudo as mais complexas, possuem alta estabilidade termodinâmica. Apenas o metano, que é a molécula mais simples (CH4), pode se formar em condições de pressão e temperatura mais baixas. Os demais hidrocarbonetos não são formados espontaneamente nas camadas superficiais da terra.
Nomenclatura de hidrocarbonetos
1-Subdivisões dos hidrocarbonetos
A fim de facilitar o estudo e a nomenclatura dos hidrocarbonetos, eles são divididos em subgrupos,dos quais serão mostrados agora:
Em cadeias abertas(também chamada de acíclica ou alifática) os subgrupos podem ser: Alcanos,Alcenos,Alcinos e Alcadienos. Já em cadeias fechadas e não aromática é Ciclanos e Ciclenos e em cadeias aromáticas é Aromáticos:

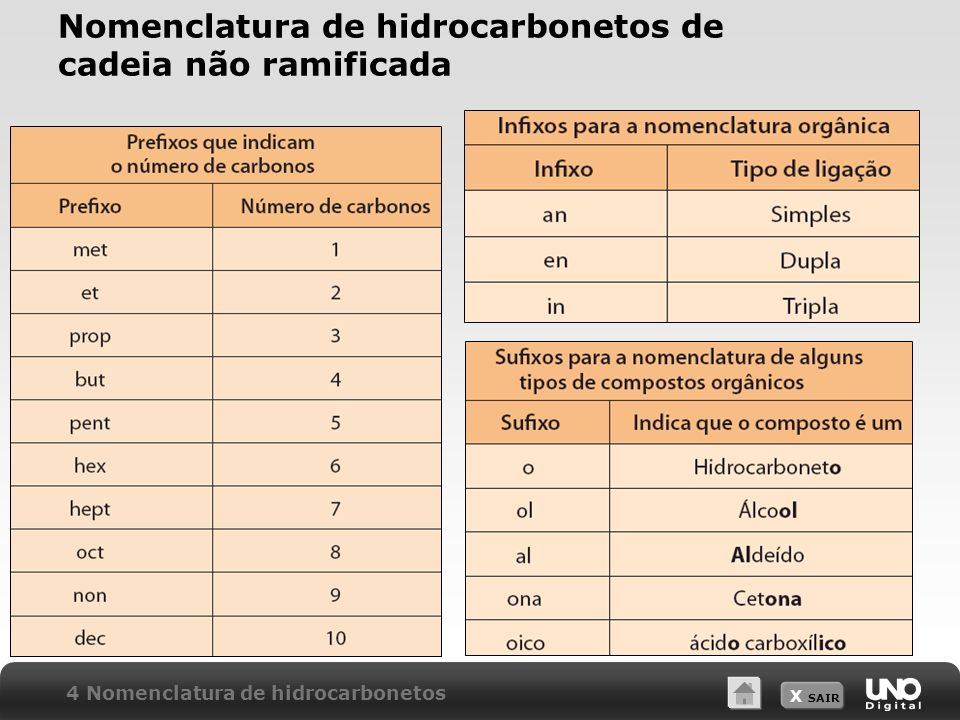


Nomenclatura de hidrocarbonetos de cadeia não ramificada
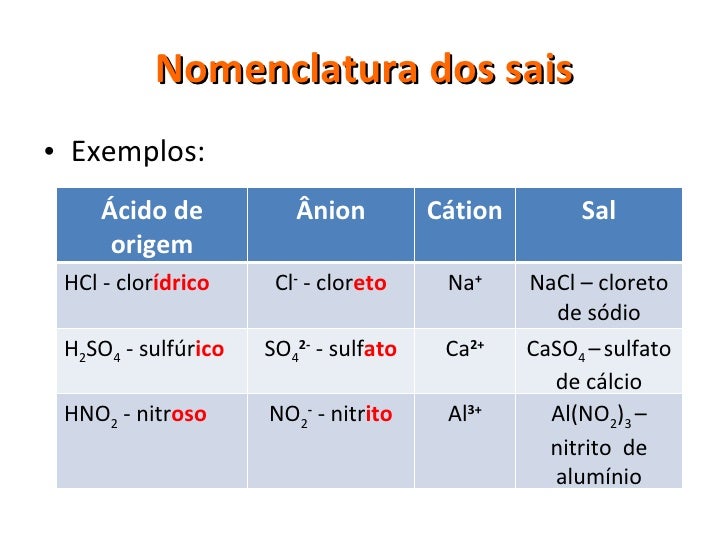
Os químicos elaboraram um método lógico para dar nome aos compostos orgânicos, pois é impossível decorar tantos nomes.Segundo as regras elaboradas pela União Internacional de Química Pura e Aplicada(IUPAC), o nome de um composto orgânico é pela união de três fragmentos:
PREFIXO+INFIXO+SUFIXO

OBS: Como estamos estudando Hidrocarbonetos usaremos sempre o sufixo O
Quando uma molécula apresenta cadeia cíclica, devemos acrescentar o prefixo ciclo antes- do nome
É necessário indicar no nome a localização da insaturação quando houver mais de uma posição possível para ela.
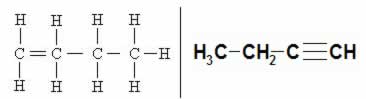
EX:H2C=CH-CH2-CH3 but-1-eno
H3C-CH=CH-CH3 but-2-eno
Nome dos principais grupos orgânicos

DICAS:1-Localize a cadeia principal
2-Se ela for saturada,comece pela extremidade que apresente insaturação mais próxima a ela e se for saturada,comece pela extremidade que tenha uma ramificação mais próxima a ela.
3-Escreva o número da localização dela
4-Siga a ordem alfabética
5 4 3 2 1
EX:H3C-CH2-CH2-CH-CH3 2-METIL-PENTANO(4-METIL-PENTANO ESTA ERRADO)
l
CH3
E por fim que essa postagem ta ficando muito grande
USO DOS PREFIXOS ORTO,META E PARA
Até mais.
QUE O,QUE O,QUE O RAPAZ