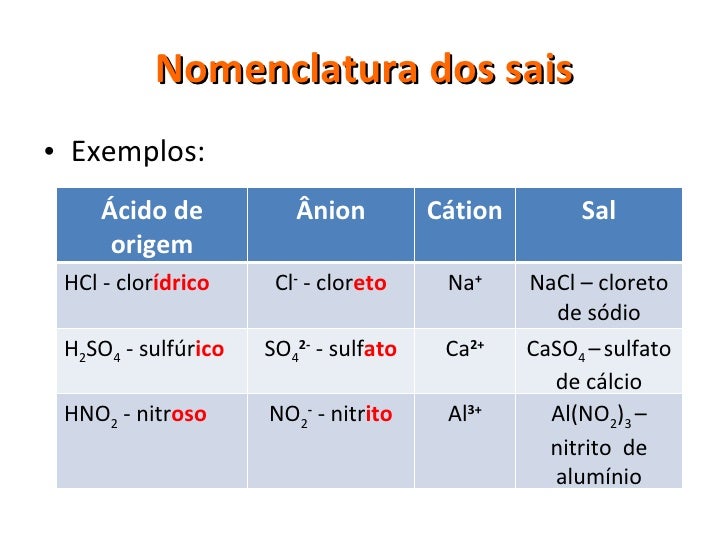
Sais são compostos que em água se dissociam num cátion diferente de H+ e um ânion diferente de OH-. A atenção cabe aos ácidos e bases, substâncias que podem formá-los a partir de uma neutralização, parcial ou total.
NEUTRALIZAÇÃO TOTAL
A neutralização total ocorre quando, na equação química, há H+ e OH- na mesma quantidade, formando H2O. O restante será o sal formado. Vejamos exemplos de equações.
2HNO3+Ca(OH)2→Ca(NO3)2+2H2O
H2SO4+2NaOH→Na2SO4+2H2O
H2SO4+2NaOH→Na2SO4+2H2O
Os sais foram totalmente neutralizados.
HCl+Ca(OH)2→Ca(OH)Cl+H2O
H2CO3+NaOH→NaHCO3+2H2O
x
NEUTRALIZAÇÃO PARCIAL
A neutralização parcial ocorre quando, na equação química, há H+ e OH- em quantidades diferentes, formando H2O e o íon que estiver em excesso estará na fórmula do sal. Dependendo do íon, o sal será ácido (cátion) ou básico (ânion). Vejamos exemplos de equações.
HCl+Ca(OH)2→Ca(OH)Cl+H2O
H2CO3+NaOH→NaHCO3+2H2O
Os sais foram parcialmente neutralizados.
FONTE: SLIDESHARE, Funções Inorgânicas:
Disponível em:
<http://pt.slideshare.net/estead2011/funcoes-inorganicas>
Acesso em: 24 abr. 2016.
Então é isso! Espero MUITO que tenha gostado. Se gostou, compartilhe essa postagem com seus amigos, não tenha vergonha de espalhar o conhecimento para as pessoas! Fico por aqui.
Vejo você em breve.










Nenhum comentário:
Postar um comentário