Os compostos inorgânicos sofrem ionização quando dissolvidos em água, porém nem todas as moléculas conseguem sofrer tal processo. Dependendo do grau da ionização (define a condutividade elétrica), é possível saber a força desses compostos e, consequentemente, sua solubilidade em água.
ÁCIDOS
Para calcular o grau de ionização dos ácidos, basta utilizar a seguinte fórmula:
Ao realizar este cálculo com qualquer ácido, é possível determinar sua força:
Para ácidos inorgânicos oxigenados, é possível calcular através de parâmetros, sendo a única exceção o ácido carbônico (H2CO3), que é um ácido fraco.
Para ácidos inorgânicos não oxigenados, vai de acordo com a família 7A:
- FORTES: HCl, HBr e HI;
- MODERADO: HF;
- FRACOS: HCN, H2S e outros.
BASES
Para indicar a solubilidade de uma base, é necessário ter conhecimento das famílias 1A e 2A:
- SOLÚVEIS: Bases da família 1A e amônia;
- PARCIALMENTE SOLÚVEIS: Bases da família 2A (exceto Mg(OH)2)
- INSOLÚVEIS: Mg(OH)2 e outros.
As bases fortes são solúveis ou parcialmente solúveis. Já as bases fracas são insolúveis, exceto a amônia (NH3).
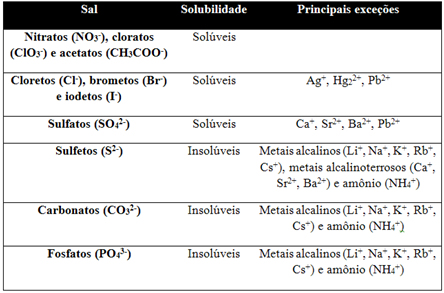
SAIS
A seguir uma tabela simplificada para determinar a solubilidade dos sais:
Muito obrigado pela leitura!
Vejo vocês em breve.














Nenhum comentário:
Postar um comentário