 |
| Equilíbrio químico é dinâmico. |
- I - Noções iniciais
- II - Equilíbrios homogêneos
- III - Equilíbrios iônicos
- IV - Equilíbrios heterogêneos
Constante de acidez e basicidade
Um ácido em água ioniza, liberando H₃O⁺ e um ânion, e uma base dissocia liberando OH⁻ e um cátion:
HCl + H₂O ⇌ H₃O⁺ + Cl⁻
NaOH + H₂O ⇌ Na⁺ + OH⁻
A constante de equilíbrio de cada um é dada por:
Como a água atua como solvente, podemos considerar sua concentração praticamente constante e incluir o valor [H₂O] em Kc:
Ki é a constante de ionização, para ácidos, bases, sais. (eletrólitos)
Quanto maior o valor de Ki (Ka para ácidos e Kb para bases), maior a ionização ou dissociação do ácido ou base, portanto, maior sua força. Esses valores também só variam com a temperatura.
O grau de ionização ou de dissociação também mede a força de um ácido ou base. Quanto maior o valor de ⍺, mais forte é o ácido ou base.
Lei de Diluição de Ostwald
Willhelm Ostwald, estudando os equilíbrios iônicos, deduziu a seguinte lei, chamada de Lei de Diluição de Ostwald:
Sendo M a molaridade da substância a ser dissociada ou ionizada, e ⍺ sendo o grau de ionização ou de dissociação dela.
Para eletrólitos fracos, ácidos e bases fracos ou sais pouco solúveis, ⍺ tenderá a 0, portanto, podemos dizer que (1 - ⍺) será aproximadamente igual a 1, logo:
Deslocamento do equilíbrio iônico
Já que a maioria dos equilíbrios iônicos se dão em meio aquoso, eles praticamente não sofrem deslocamento com a variação de pressão. Considerando a temperatura constante, os fatores que podem deslocar um equilíbrio iônico são a variação na concentração de reagentes e produtos.
Considere a ionização do ácido fluorídrico (HF):
HF + H₂O ⇌ H₃O⁺ + F⁻
Suponha que adicionamos certa quantidade de fluoreto de sódio na solução. Veja a dissociação do NaF:
NaF → Na⁺ + F⁻
Perceba que a concentração de íon fluoreto, F⁻, aumentará. Logo, seguindo o princípio de Le Chatelier, a tendência será de minimizar o excesso do íon, fazendo-o formar HF, deslocando o equilíbrio para a esquerda. Esse fenômeno é chamado de efeito do íon comum.
Agora, considere o equilíbrio iônico da dissolução de dicromato de potássio (K₂Cr₂O₇) em água:
(OBS: o potássio não é colocado na reação pois ele não afeta o equilíbrio)
A adição de NaOH, por exemplo, Os íons OH⁻ neutralizarão o H₃O⁺, deslocando o equilíbrio para a direita, para compensar a perda de íon hidrônio.
Isso é chamado de efeito do íon não comum. Perceba que, se no equilíbrio anterior fosse adicionado um ácido como HCl, o equilíbrio se deslocaria para a esquerda, pois haveria um excesso de H₃O⁺.
Equilíbrio iônico da água
pH e pOH
A água também se ioniza, porém muito fracamente:
Sua constante de equilíbrio é dada por:
Sendo a ionização extremamente pequena, podemos considerar a concentração de água constante. Multiplicando-a pela constante de equilíbrio, teremos o seguinte:
Esse valor varia apenas com a temperatura. (Kw a 25 ºC ≅ 1 × 10⁻¹⁴)
- Solução ácida: [H₃O⁺] > [OH⁻]
- Solução básica: [H₃O⁺] < [OH⁻]
- Solução neutra: [H₃O⁺] = [OH⁻]
pH e pOH
Percebendo que os valores de [H₃O⁺] e [OH⁻] são geralmente muito baixos, e para evitar cálculos com expoentes negativos, convencionou-se representar esses valores através de logaritmos.
Daí surge o conceito de potência hidrogeniônica (pH) e potência hidroxiliônica (pOH), muito vistas em laboratórios. É importante ressaltar que o pH é bem mais usado que o pOH.
Ou seja, para [H₃O⁺] = 10⁻², o pH será igual a 2. A 25 ºC, vale a seguinte relação:
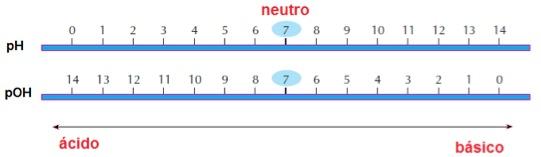
pH + pOH = 14
Ou seja, quanto maior for [H₃O⁺], menor será o pH, e maior será o pOH. Da mesma forma, quanto menor for [H₃O⁺], maior será o pH, e menor será o pOH. É possível encontrar pKa e pKb para as respectivas constantes de acidez e basicidade, em que a fórmula é a mesma.
- Água pura: pH = pOH = 7
- Solução ácida: pH < 7 < pOH
- Solução básica: pOH < 7 < pH
Solução-tampão
Solução-tampão é uma solução que estabiliza seu pH com a adição de
pequenas quantidades de ácido ou base fracos.
pequenas quantidades de ácido ou base fracos.
O sangue humano é tamponado para manter um pH em torno de 7,3 a 7,5, com o auxílio de vários ácidos, bases e sais.
Imagine, por exemplo, uma solução-tampão com ácido acético, CH₃COOH, um ácido fraco, e um de seus sais, como o acetato de sódio (CH₃COONa). As respectivas reações de ionização do ácido e dissociação do sal são:
CH₃COOH + H₂O ⇌ H₃O⁺ + CH₃COO⁻ (ionização fraca)
CH₃COONa → Na⁺ + CH₃COO⁻ (dissociação total)
Ao adicionar um ácido nessa solução, o equilíbrio estabelecido na primeira reação será perturbado, imediatamente deslocando-o para a esquerda, igualando a quantidade de H₃O⁺. Como não haverá alteração na acidez devido ao deslocamento do equilíbrio, o pH permanece inalterado.
Ao adicionar uma base, ocorrerá sua neutralização devido ao H₃O⁺, não aumentando a basicidade e mantendo o pH no seu valor original, e a dissociação do acetato de sódio pode prover uma "reserva" para a primeira reação.
Hidrólise de sais
Alguns sais podem reagir com a água, de forma que um cátion dissociado possa "extrair" um íon OH⁻ de uma molécula de água, formando uma base, e que um ânion possa "extrair" um íon H⁺ da água, formando um ácido. Esse fenômeno é chamado de hidrólise do sal:
Perceba que se estabelece um equilíbrio químico aí, já que a reação pode ocorrer tanto no sentido direto quanto no inverso, sendo uma reação reversível.
Se o ânion e o cátion são provenientes respectivamente de ácido e base fortes, ao entrar em contato com a água eles se mantêm predominantemente dissociados. Sendo assim, concluímos que os cátions que formam as bases fortes não têm afinidade por íons hidróxido, OH⁻, e os ânions que formam os ácidos fortes não têm afinidade por prótons, H⁺, e, portanto, não reagem com a água:
NaOH + HCl → NaCl + H₂O
NaCl + H₂O → não há reação
Se o ânion é proveniente de um ácido forte e o cátion de uma base fraca, o ácido vai dissociar completamente a a base vai ter a maioria de suas moléculas agregadas. Logo, os cátions terão grande afinidade por íons hidróxido, OH⁻, enquanto os ânions não. Sendo assim, para o NH₄Cl, os íons amônio, NH₄⁺, sofrerão hidrólise. De forma mais simples, vão "extrair" um íon hidróxido da água, sobrando H⁺, que logo se juntará a outra molécula de água, formando H₃O⁺ e tornando o meio ácido:
Se o ânion é proveniente de um ácido fraco e o cátion de uma base forte, por exemplo no cianeto de potássio (KCN), o CN⁻ vai "extrair" um próton (H⁺), sobrando OH⁻, tornando o meio alcalino ou básico:
Se o ânion e cátion são provenientes respectivamente de ácido e base fracos, o ânion vai "extrair" um próton e a base um íon hidrônio por terem afinidade, formando um ácido e uma base, deixando o pH da solução inalterado:
O grau de hidrólise é definido por:
A constante de hidrólise pode ser calculada, mas tenha em mente que se deve sempre considerar a equação "iônica" da hidrólise. Como as soluções geralmente são bastante diluídas, admitiremos [H₂O] constante, e multiplicando Kc.
A fórmula geral pode ser descrita a seguir: (você terá que eliminar alguns fatores)
Por exemplo, no caso de íons de ácido forte e base fraca, eliminamos [ânion], [OH⁻] e [ácido] da fórmula. Já para íons de ácido fraco e base forte, eliminamos [H⁺], [cátion] e [base] da fórmula. E por fim, em íons de ácido e base fracos, eliminamos [H₃O⁺] e [OH⁻] de nossa fórmula geral.























Nenhum comentário:
Postar um comentário