 |
| Uma das ferramentas mais importantes de um químico. |
Módulo: Tabela periódica
- I - Introdução e organização da tabela periódica
- II - Propriedades periódicas e aperiódicas
Introdução
Em 1869, um professor de Química da Universidade de São Petersburgo (Rússia), Dimitri Ivanovich Mendeleev (1834-1907), estava escrevendo um livro sobre os elementos conhecidos na época — cerca de 63 —, cujas propriedades ele havia anotado em fichas separadas.
Ao trabalhar com suas fichas, ele percebeu que, organizando os elementos em função da massa de seus átomos (massa atômica), determinadas propriedades se repetiam diversas vezes, isto é, eram propriedades periódicas.
Tabelas modernas mostram, no entanto, que os átomos estão em ordem crescente de acordo com o número atômico, e não da massa atômica, como se pensava anteriormente a partir da Lei da Periodicidade, de Henry G. J. Mosley:
"Muitas propriedades físicas e químicas dos elementos variam periodicamente na seqüência de seus números atômicos."
Organização
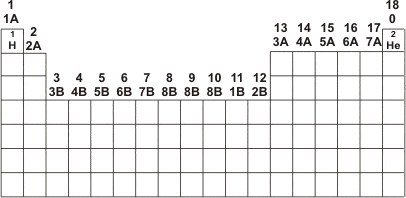
A tabela está dividida em linhas, chamadas períodos, que variam de 1 a 7, e em colunas, chamadas de famílias ou grupos.
O período em que o elemento se encontra determina seu nível de energia. Quanto maior o período, maior seu nível energético.
A família do elemento determina suas propriedades. Por exemplo, o sódio está na família 1A, e o potássio também. De acordo com e Lei da Periodicidade, eles terão propriedades semelhantes, o que realmente ocorre. A família pode ser numerada de forma absoluta, de 1 a 18, ou com um número e letra.
Os elementos da família A são chamados de representativos (1, 2, 13, 14, 15, 16, 17, 18/0), e os da B são chamados de metais de transição (3~12). Os representativos possuem seu elétron mais energético no subnível s ou p. Os de transição possuem o subnível d incompleto. Há ainda os de transição interna, chamados de lantanídeos e actinídeos, que possuem o subnível f incompleto. Eles estão abaixo da tabela periódica.
Classificação dos elementos
Os elementos podem ser classificados (de forma menos detalhada) de acordo com sua tendência de ionização ou propriedades. Veja suas características gerais:
- Os metais tem tendência a perder elétrons, possuem boa condutividade elétrica e térmica, possuem brilho característico, são dúcteis, maleáveis, e possuem pontos de fusão e ebulição relativamente altos. Eles podem existir no ambiente isolados através da formação de ligas metálicas;
- Os semimetais possuem características intermediárias entre metais e ametais. Esta nomenclatura está ultrapassada, e os elementos deste grupo devem ser considerados metais ou ametais dependendo da situação;
- Os ametais tem tendência a ganhar elétrons, e possuem propriedades contrárias aos metais;
- Os gases nobres constituem uma única família (8A). Estes elementos não tem tendência a ganhar nem perder elétrons, como veremos a seguir;
- O hidrogênio não se enquadra em nenhuma família. Ele encontra-se na posição da família 1A devido a sua valência 1s¹. Ele tem tendência a ganhar elétrons, logo, é um ametal.
- Os elementos da família 1A ou grupo 1 (Li, Na, K, Rb, Cs, Fr) são chamados de metais alcalinos, devido à sua capacidade de se unir a hidroxilas, formando bases. Estes elementos são os elementos mais reativos da tabela periódica, e reagem violentamente com a água. Possuem a configuração ns² np¹, tendo tendência a perder 1 elétron para se igualar ao hélio;
- Os elementos da família 2A ou grupo 2 (Be, Mg, Ca, Sr, Ba, Ra) são chamados de alcalinoterrosos, porque também formam bases, e seus óxidos antigamente eram chamados de terra, Também são altamente reativos, e tendem a perder 2 elétrons;
- Os elementos da família "B" ou grupo 3~12 são os metais de transição. Eles possuem o subnível d ou f incompleto, e possuem propriedades semelhantes aos metais, apesar de serem intermediárias. Estes elementos possuem variados estados de oxidação;
- Os elementos da família 3A (B, Al, Ga, In, Tl) ou grupo 13 tendem a perder 3 elétrons (com exceção com boro). Já existe um ametal na família, o boro. Esta exceção se estabiliza com 6 elétrons, ou seja, deve ganhar 3 elétrons.
- Os elementos da família 4A (C, Si, Ge, Sn, Pb) ou grupo 14 possuem maior caráter ametálico que a família 3A. Os elementos deste grupo possuem valência 4, com tendência a ganhar 4 elétrons. O único metal da família é o chumbo (Pb), que pode perder 2 ou 4 elétrons. O elemento mais importante dessa família é o carbono, que é essencial à vida;
- Os elementos da família 5A (N, P, As, Sb, Bi) ou grupo 15 já possuem um alto caráter ametálico. Os ametais deste grupo tendem a ganhar 3 elétrons;
- Os elementos da família 6A (O, S, Se, Te, Po) ou grupo 16 são chamados de calcogênios (formadores de cobre), pois os minérios de cobre possuem compostos com estes elementos. Ex. CuS. Os elementos dessa família tem tendência a ganhar 2 elétrons. O elemento mais importante dessa família é o oxigênio, que participa dos mais diversos compostos e reações;
- Os elementos da família 7A (F, Cl, I, Br, At) ou grupo 17 são chamados de halogênios, que significa formador de sais. Os elementos deste grupo estão entre os mais eletronegativos, e tendem a ganhar um elétron;
- Os elementos da família 8A ou grupo 18 ou 0 (He, Ne, Ar, Kr, Xe, Rn) são os elementos fundamentais, os gases nobres. Quando um metal perde elétrons ou um ametal ganha, é com o objetivo de que sua configuração eletrônica fique igual a de um gás nobre, pois os gases nobres possuem uma configuração que obedece à regra do octeto (com exceção do He, que se estabiliza com 2 elétrons). Por essa razão, os gases nobres só são encontrados isolados no ambiente, e são extremamente difíceis de reagir. Daí o nome nobres.









Nenhum comentário:
Postar um comentário