Definição das reações de simples troca.
REAÇÃO DE SIMPLES TROCA
As reações de simples troca acontecem apenas quando o elemento B é menos reativo que o elemento A. Caso o elemento A seja um metal, o elemento B deslocado também será um metal, e a mesma regra se aplica a não-metais. Para descobrir se a reação ocorrerá ou não, deve-se consultar a fila de reatividade.
Baseado nessas informações, é possível classificar uma reação de simples troca e se ela ocorre ou não.
FeS2 + Ca → Fe + CaS2
Cu + HCl → Não ocorre.
Definição das reações de dupla troca.
REAÇÕES DE DUPLA TROCA
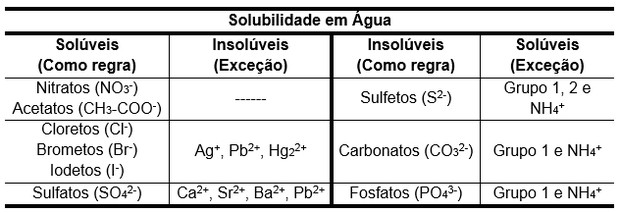
As reações de dupla troca acontecem quando o elemento A desloca o elemento C, fazendo com que um dos produtos seja classificado como menos ionizado (l), mais volátil (g) ou insolúvel (s). Para esta última classificação, é necessário consultar a tabela de solubilidade.
Para melhor ilustrar as reações de dupla troca, confira alguns exemplos abaixo.
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
CH3COOH(aq) + NaHCO3(s) → CH3COONa(aq) + CO2(g) + H2O(l)
AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq)
NaNO3(aq) + HCl(aq) → Não ocorre.
Observação: O ácido H2CO3, por ser instável, sofre uma reação de decomposição, formando CO2 + H2O.
Na+(aq) + Cl-(aq) + Ag+(aq) + NO3-(aq) → AgCl(s) + Na+(aq) + NO3-(aq)
EQUAÇÕES IÔNICAS
Para transformar uma equação de deslocamento em equação iônica, deve-se seguir alguns passos.
1º passo: insira a equação desejada.
Zn + CuSO4 → Cu + ZnSO4
NaCl(aq) + AgNO3(aq) → AgCl(s) + NaNO3(aq)
2º passo: transforme todos os compostos aquosos em íons.
Zn + Cu2+ + SO42- → Cu + Zn2+ + SO42-
Na+(aq) + Cl-(aq) + Ag+(aq) + NO3-(aq) → AgCl(s) + Na+(aq) + NO3-(aq)
3º passo: cancele todos os elementos iguais de cada membro.
Zn + Cu2+ + SO42- → Cu + Zn2+ + SO42-
4º passo: faça uma nova equação com os elementos restantes.
Zn + Cu2+ → Cu + Zn2+
Cl-(aq) + Ag+(aq) → AgCl(s)
Hope that you liked it.

.jpg)









Nenhum comentário:
Postar um comentário