Olá amigos!
Bem-vindos ao ano de 2016 aqui no Prático & Básico. As aulas já estão voltando e nós também. Começaremos hoje falando da condutividade elétrica de soluções aquosas. Precisamos saber quais soluções possuem essa condutividade elétrica e quais os motivos/processos envolvidos.
DISSOCIAÇÃO IÔNICA
O cloreto de sódio (NaCl) é uma substância que possui ligação iônica. Quando misturado em água, os íons presentes em seu retículo cristalino são separados. O processo que separou os íons é chamado de dissociação iônica. Lembrem-se de que os compostos iônicos são, em meio aquoso, ótimos condutores de eletricidade.
IONIZAÇÃO
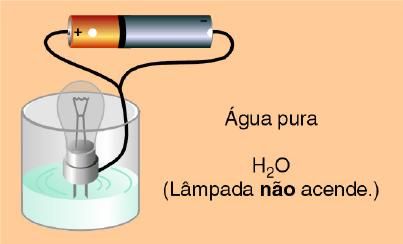
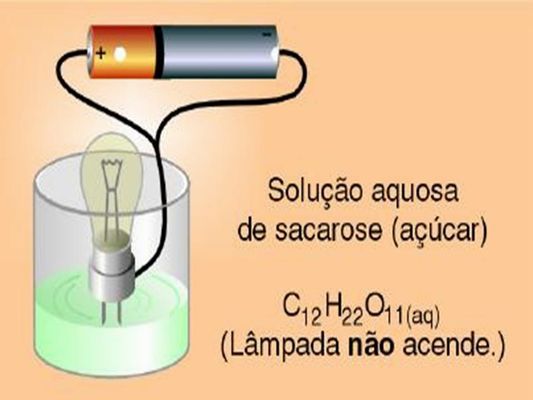
E uma substância que possui ligação covalente pode conduzir eletricidade? Vejamos as imagens abaixo.
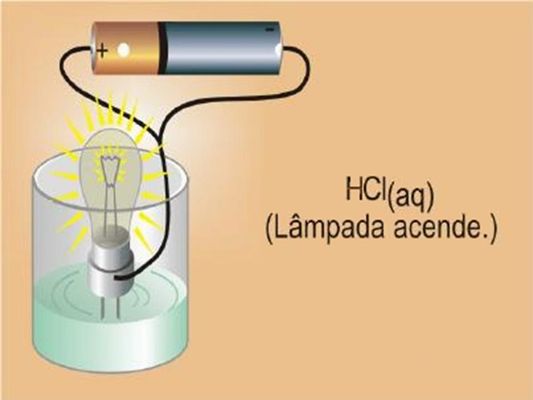
Na água pura e na solução aquosa de sacarose a lâmpada não acendeu, porém na solução de HCl ocorreu o contrário. Isso é porque algumas substâncias moleculares como a sacarose, quando dissolvidas em água, são as moléculas que se separam, pois não há íons.
Já no caso do ácido clorídrico (HCl), as moléculas além de se separarem, são quebradas. Isso faz com que o hidrogênio transfira um elétron para o cloro (H+Cl−), libertando os íons para se movimentar e assim conduzindo eletricidade. Este processo se chama ionização.
Portanto, as soluções iônicas ou eletrolíticas são aquelas que possuem íons e conduzem eletricidade e as soluções moleculares não possuem íons, logo não conduzem eletricidade. As substâncias que misturam em água e conduzem corrente elétrica são chamadas de eletrólitos.
Então é só isso! Muito obrigado a todos que chegaram até o final do post e gostaram dele. Pretendemos fazer com que 2016 seja muito melhor que o ano passado, e contamos com a sua visita para continuarmos com nosso trabalho!
Vejo vocês em breve.








Nenhum comentário:
Postar um comentário